使用高準確度資料擷取模組快速實作流式細胞儀設計
資料提供者:DigiKey 北美編輯群
2022-04-21
臨床醫生和診斷專家已將流式細胞術廣泛用於分析細胞特徵。此技術以光學方式逐一評估每個細胞的蛋白質含量、血液健康狀況、粒度、細胞大小以及其他屬性。雖然細胞儀是非常靈敏的系統,但細胞儀設計人員一直承受著加快分析時間的壓力,因此流式細胞術及其相關電子元件都需採用新的作法。
細胞儀會使用雷射光照射個別細胞,以產生散射訊號及螢光訊號。要快速準確地擷取產生的光,並將其轉換成數位訊號,就需要使用突崩光電二極體 (APD) 和複雜的電子元件。設計和實作實現此流程的電路可能要花很長的時間,尤其流式細胞術的資料擷取系統,須具備高速、低雜訊的裝置才能確保系統的準確性。
若要以符合成本效益的方式來加快流式細胞術分析,設計人員可使用具有內部放大器驅動器和類比數位轉換器 (ADC) 的資料擷取解決方案來解決速度和準確度的問題。
本文將概述流式細胞術系統的運作原理。之後會介紹 Analog Devices 的 18 位元 ADC 模組 ADAQ23878,並說明如何使用此模組設計流式細胞儀的偵測與轉換階段。同時還會介紹相關的評估套件。
現代流式細胞術的原理
現代流式細胞術採用自動化流程來分析細胞和表面分子,並且會特性化及定義異質細胞群中的不同細胞類型。若不計準備時間 (可能超過一小時),儀器可在一分鐘內對 10,000 個單細胞進行一次涵蓋三至六種特徵的評估。
若想做到這點,流式細胞術的單細胞準備步驟至關重要。樣本會在流體動力的作用下懸浮於鞘液,將細胞或粒子聚焦到狹窄的單細胞列樣本流中,以便分析。在此轉化下,單細胞必須保持其自然生物特徵及生化組成。
圖 1 是流式細胞儀的圖片,首先會在頂端加入多細胞樣本。
 圖 1:從鞘管聚焦到資料擷取的流式細胞儀示意圖。(圖片來源:Wikipedia,經 Bonnie Baker 修改)
圖 1:從鞘管聚焦到資料擷取的流式細胞儀示意圖。(圖片來源:Wikipedia,經 Bonnie Baker 修改)
流式細胞儀的六個主要元件是流通池、雷射、突崩光電二極體 (APD)、互阻抗放大器 (TIA)、ADC 以及用於資料收集和分析的電腦。
流式細胞儀配有液流或鞘液,這兩者會被窄化,讓細胞排成單列通過光束。雷射光一次會擷取一個細胞,產生前向散射光 (FSC) 訊號和側面散射光 (SSC) 訊號。螢光會透過鏡面和濾光片進行排序,然後用 APD 放大。
下一步是在產生的光輸出到達 APD 後加以偵測、數位化及分析。對於偵測而言,Analog Devices 的 LTC6268 500 MHz 超低偏壓電流、低電壓雜訊 FET 輸入運算放大器,非常適合進行偵測所需的高速 TIA。
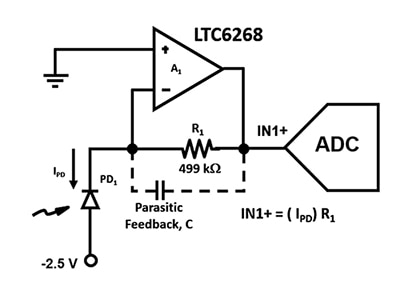 圖 2:TIA 電路使用 APD (PD1) 和低輸入電流 FET 運算放大器,將超低光電二極體電流轉換成 IN1+ 的輸出電壓。(圖片來源:Bonnie Baker)
圖 2:TIA 電路使用 APD (PD1) 和低輸入電流 FET 運算放大器,將超低光電二極體電流轉換成 IN1+ 的輸出電壓。(圖片來源:Bonnie Baker)
設計此放大器電路時,必須盡可能採用最大的頻寬,因此必須將寄生電容降至最低。例如,寄生回授電容 C 會影響圖 2 的電路穩定性和頻寬。無論選擇何種電阻器封裝,放大器回授路徑中始終都會有寄生電容。但是,0805 封裝是高速應用的首選,其端蓋間的距離較長,寄生電容量也最低。
增加 R1 端蓋間的距離並非降低電容的唯一方法。降低板對板電容量還有另一個方法,就是在電阻 R1 下額外增設一條接地走線,以遮蔽導致寄生電容的電場路徑 (圖 3)。
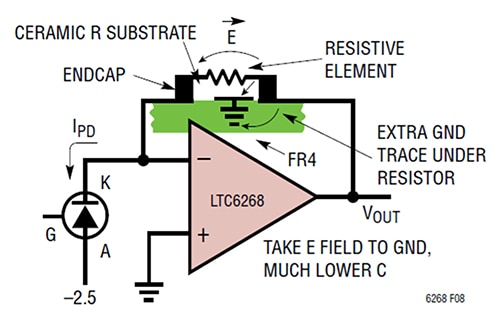 圖 3:在回授電阻下增設接地走線,可將電場分流遠離回授端,並將其傾洩至接地。(圖片來源:Analog Devices)
圖 3:在回授電阻下增設接地走線,可將電場分流遠離回授端,並將其傾洩至接地。(圖片來源:Analog Devices)
在本例中,此作法明確涉及在 TIA 輸出端附近的電阻焊盤下方和之間設置一條短的接地走線。此方法可讓寄生電容值達到 0.028 pF,且 TIA 頻寬達到 1/(2π*RF*CPARASITIC),相當於 11.4 MHz。
光訊號會導向幾個帶有適當濾光片的突崩式二極體。APD、TIA 和 ADC 系統會將這些訊號轉換成數位型式,並將資料傳送至微處理器進一步分析。
現代細胞儀通常會有多個雷射和 APD。現行的商用裝置會有十個雷射和三十個突崩光電二極體。增加雷射和光電倍增偵測器的數量,就可進行多個抗體標示,進而利用表型標記精確辨識目標群。
不過,分析速度取決於以下因素是否達到微妙平衡:
- 鞘液速度
- 流體動力聚焦過程形成單細胞列的能力
- 隧道直徑
- 保持細胞完整性的能力
- 電子元件
流式細胞術聲波聚焦
雖然增加多個雷射和 APD 能加快分析和辨識的速度,但最新的現代化單細胞流式細胞儀每分鐘最多能收集多達 100 萬個細胞的資料。在許多應用中,例如在血液中偵測每毫升最少只有 100 個循環腫瘤細胞時,此處理能力遠遠不足。在罕見細胞的臨床應用中,檢驗通常需要對數十億個細胞進行耗時的分析。
流體動力聚焦細胞的準備過程有個替代方法就是採用聲波聚焦過程。在此過程中,會將鋯酸鈦酸鉛 (PZT) 等壓電材料,連接至一根玻璃毛細管,以將電氣脈衝轉換成機械振動 (圖 4a)。利用 PZT 在矩形流通池的共振頻率下振動玻璃毛細管的側壁,系統就會產生多種壓力節點數量不一的聲音駐波。
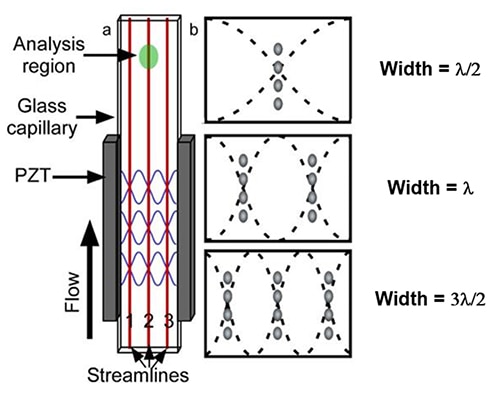 圖 4:以矩形玻璃毛細管製成的聲波流通池圖示 (a)。固定寬度毛細管前三個壓力節點的位置 (b)。(圖片來源:美國國家生物技術資訊中心)
圖 4:以矩形玻璃毛細管製成的聲波流通池圖示 (a)。固定寬度毛細管前三個壓力節點的位置 (b)。(圖片來源:美國國家生物技術資訊中心)
這些 PZT 頻率節點,會將流動的粒子排列成多條離散的流線 (圖 4b)。透過產生單個或多個諧波,聲波流通池利用線性的聲音駐波調諧成各種波長。如同簡易的線性駐波模型所預測,樣本中的細胞會在流動腔內產生單個或多個單細胞列。
細胞在這樣縝密的排列下,便可增加鞘液隧道的寬度,以加速流過雷射光束 (圖 5)。
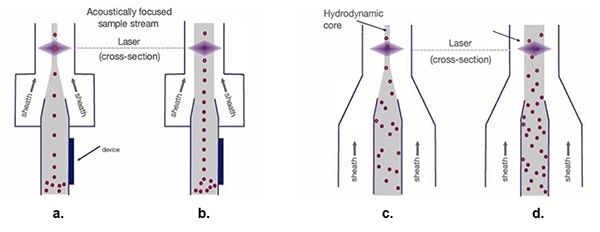 圖 5:在流體動力樣品流下 (c.和 d.),隨著鞘寬度增加,細胞樣品會分散,因此光學測量流程並不容易。而聲波聚焦樣品流 (a.和 b.) 在任何鞘寬度下都能讓細胞維持一列。(圖片來源:Thermo Fischer Scientific)
圖 5:在流體動力樣品流下 (c.和 d.),隨著鞘寬度增加,細胞樣品會分散,因此光學測量流程並不容易。而聲波聚焦樣品流 (a.和 b.) 在任何鞘寬度下都能讓細胞維持一列。(圖片來源:Thermo Fischer Scientific)
傳統的流體動力聚焦 (圖 5c.),會將單細胞排成列,為雷射掃描做準備。雖然樣本流核心的漏斗越寬,鞘材質的速度越快 (圖 5d.),但也會導致單細胞列分散,造成訊號變化且有損資料品質。
聲波聚焦 (圖 5a.) 則可讓生物細胞和其他粒子排列對齊,即使隧道較寬也沒問題。這種精確的細胞排列對齊,可提高取樣率,同時還可維持資料的品質 (圖 5b.)。
實際上,流式細胞術聲波聚焦可將細胞取樣頻率提高大約 20 倍 (圖 6)。
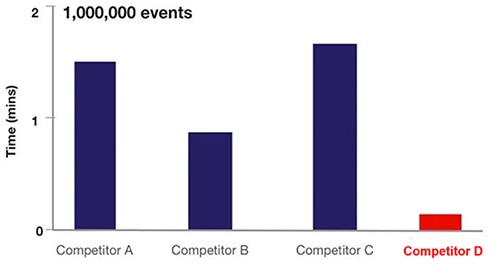 圖 6:各種以流體流式細胞術 (A、B、C) 與聲波聚焦細胞術 (D) 為基礎的流式細胞術設備取樣時間之比較。(圖片來源:Thermo Fischer Scientific)
圖 6:各種以流體流式細胞術 (A、B、C) 與聲波聚焦細胞術 (D) 為基礎的流式細胞術設備取樣時間之比較。(圖片來源:Thermo Fischer Scientific)
在圖 6 中,A、B、C 的設備採用流體動力技術,D 則採用了聲波聚焦流式細胞術方法。
聲波聚焦流式細胞術的資料擷取
在設計聲波聚焦流式細胞術設備的電子元件時,需使用高速光感電子元件,以適應血球細胞和鞘液通過大直徑噴嘴的速度。先前提到的 600 MHz 高速 LTC6268,結合專用的 0805 電阻封裝佈局,就可讓光學感測速率高達 11.4 MHz (圖 7,左側)。LTC6268 的輸出會饋送至 Analog Devices 的 ADAQ23878 ADC 進行數位化。
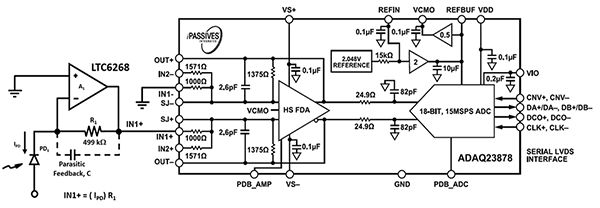 圖 7:ADAQ23878 ADC 可將光電二極體 (PD1) 和 TIA 電路 (左) 的光學訊號數位化。(圖片來源:Bonnie Baker)
圖 7:ADAQ23878 ADC 可將光電二極體 (PD1) 和 TIA 電路 (左) 的光學訊號數位化。(圖片來源:Bonnie Baker)
ADAQ23878 是 18 位元、15 MSPS 的精密型高速系統級封裝 (SIP) 資料擷取解決方案。此解決方案可大幅縮短精密測量系統的開發週期,設計人員不必再煩惱挑選、最佳化與佈局作業,因為此裝置已經打點好一切。
SIP 模組化作法可減少終端系統元件數量,將多個通用訊號處理和調節區塊整合在單一裝置中,再搭配 18 位元、15 MSPS 的高速連續漸近暫存器 (SAR) ADC。這些區塊包含一個低雜訊、全差動 ADC 驅動器放大器,和一個穩定的參考緩衝。
此外,ADAQ23878 還含有關鍵的被動元件,可利用 Analog Devices 的 iPassive 技術,將與溫度有關的誤差源減到最低,並且達到最佳化效能。此 ADC 的快速趨穩式驅動器級則有助於確保迅速擷取資料。
評估 ADAQ23878 µModule
為了評估 ADAQ23878,Analog Devices 推出了 EVAL-ADAQ23878FMCZ 評估板 (圖 8)。此板件可展示 ADAQ23878 μModule 的效能,是一款評估流式細胞術前端設計及其他多種應用的多功能工具。
 圖 8:EVAL-ADAQ23878FMCZ 評估板適用於 ADAQ23878,具有板載電源電路,並搭載相關軟體可進行控制與資料分析,並且相容於 SDP-H1。(圖片來源:Analog Devices)
圖 8:EVAL-ADAQ23878FMCZ 評估板適用於 ADAQ23878,具有板載電源電路,並搭載相關軟體可進行控制與資料分析,並且相容於 SDP-H1。(圖片來源:Analog Devices)
EVAL-ADAQ23878FMCZ 評估板需要搭配 Windows 10 或更高版本的個人電腦、低雜訊精密訊號源,以及適合 18 位元測試的帶通濾波器。此評估板需要安裝 ADAQ23878 ACE 外掛程式與 SPD-H1 驅動程式。
結論
雖然使用標準的流體力學聚焦流式細胞術逐一檢查生物細胞一直都有成功表現,但快速分析的需求竄起,因此陸續轉用以聲波聚焦流式為主的技術。但若想支援更進階的流式細胞術,電子元件除了增進能力外,也要盡可能減少空間、成本和開發時間。
如本文所述,LTC6268 高速運算放大器可與 ADAQ233878 μModule 高速精密的資料擷取解決方案彼此結合,為進階的流式細胞術設備建立完整的資料擷取系統。

聲明:各作者及/或論壇參與者於本網站所發表之意見、理念和觀點,概不反映 DigiKey 的意見、理念和觀點,亦非 DigiKey 的正式原則。







